IUCLID実践セミナー テキスト
Introduction
はじめに
IUCLID sections 4 to 11 are also called "Endpoint sections". In this context, an endpoint is meant as an information requirement or data point with regard to the physico-chemical properties of the substance, environmental fate and behaviour, ecotoxicological information, toxicological information and specific information (e.g. residues in food and feedingstuffs) according to a given regulatory programme, e.g. the standard information requirements set out in the EU REACH Annexes VI to XI.
IUCLIDのセクション4から11は「エンドポイントセクション」とも呼ばれています。 この文脈においては、エンドポイントは物質の物理化学的性質、環境運命や動態、環境毒性情報、毒物学的情報、特異的情報(たとえば食品や飼料中の残存物)に関しての情報要件あるいはデータポイントを意味しています。その意味しているところは扱おうとしている規制プログラム、たとえば、EU REACH 付属書VIからXIに設定されている標準情報要件によって変わります。
A IUCLID Endpoint section provides the container for storing "endpoint study" data, e.g. a study on vapour pressure to be entered in section 4.6 Vapour pressure or a study on repeated dose toxicity (oral) to be entered in section 7.5.1 Repeated dose toxicity: oral. The term "study" has a rather generic meaning in that it refers to any experimental study, but also to an estimation or prediction method including (Q)SAR, read-across, weight of evidence evaluation, data waiving or any other type of information being relevant for a given information requirement. For more information see chapter B.4.2.2 Summaries of study reports and other information.
一つのIUCLIDエンドポイントセクションは「エンドポイント研究」データを保存するためのコンテナを提供しています。たとえば、蒸気圧に関する研究はセクション4.6 Vapour pressure4.6 蒸気圧に入力し、 経口反復投与毒性研究はセクション7.5.1 Repeated dose toxicity: oral7.5.1反復投与毒性: 経口に入力します。 「研究」という言葉はかなり総称的な意味を持っていて、それは実験的な研究を指すばかりでなく、(Q)SAR、読み込み法(read-across)、証拠評価の重みづけ、データ回避(waiving)、あるいは、扱っている情報要件に関している関するその他あらゆるタイプの情報を指しています。これについての詳しい情報は、B.4.2.2 Summaries of study reports and other information章で述べられています。
The collection of endpoint-related information in IUCLID is based on summarising descriptions of full study reports. These study summaries can be very condensed or very detailed. However, a study summary should provide sufficient information to make an assessment of the relevance of the study. Very detailed study summaries are also termed "robust study summaries", if they address all relevant study items (see chapter B.4.2.2.3.1 Definition of key studies, supporting studies, robust study summaries).
IUCLID中のエンドポイント関連情報の収集は完全研究報告書の記述を要約することが基礎となります。これらの研究要約は非常に簡単に記述することも、非常に詳しく記述することも可能です。しかしながら、研究要約は研究の適切さ(relevance)を評価するのに十分な情報を提供するものでなければなりません。非常に詳しく記述された研究要約は、それがすべての適切な研究項目を処理している場合は、「ロバスト研究要約」とも呼ばれています。(参照 B.4.2.2.3.1 Definition of key studies, supporting studies, robust study summaries)。
In IUCLID, study summaries are managed using Endpoint study records, which are templates with predefined fields and freetext prompts intended to help the user summarise a study (see chapter D.4.7.1 What is an Endpoint study record?). Each Endpoint study record of sections 4 to 10 is structured into the following main parts:
IUCLIDでは、研究要約はエンドポイント研究レコード(オブジェクト)を使用して処理されます。そのレコード(オブジェクト)は事前に定義されたフィールドとユーザが研究を要約するのを支援するフリーテキストのプロンプトとをもつテンプレートです。(参照 D.4.7.1 What is an Endpoint study record?). セクション4から10の各エンドポイント研究レコードは次の4つの主要パートで構成されています:
-
Administrative data
管理データ(Administrative data)
-
Data source
データの出典(Data source)
-
Material and methods
材料と方法(Material and methods)
-
Results and discussion
結果と考察(Results and discussion)
-
Overall remarks, attachments
総括的要約、添付(Overall remarks, attachments)
-
Applicant's summary and conclusions
申請者による要約と結論(Applicant's summary and conclusions)
Under these headings certain data entry fields are subsumed which are common to all Endpoint study records, in addition to endpoint-specific data entry fields. Because many fields are only relevant for robust study summaries, a system of detail levels has been implemented in IUCLID. This allows displaying either only the basic fields or all fields (see chapter D.4.7.6 Switching between display type "basic fields" (detail level 1) and "all fields" (detail level 2)).
これらの見出しの下には、エンドポイント独自の入力フィールドとともに、すべてのエンドポイント研究レコードに共通のフィールドが含まれています。 フィールドの多くはロバスト研究要約にのみ関係しているので、IUCLIDには詳細レベルのシステムが実装されていて、これによって基本的なフィールドのみを表示するか、全フィールドを表示するかの選択が可能になります。(参照 D.4.7.6 Switching between display type "basic fields" (detail level 1) and "all fields" (detail level 2)).
Almost all IUCLID Endpoint study records are modelled on the so-called OECD harmonised templates, which are standard formats for reporting endpoint study summaries related to any type of a chemical (e.g. pesticides, biocides, industrial chemicals) (see chapter D.4.7.1 What is an Endpoint study record?).
IUCLIDエンドポイント研究レコードのほとんどすべてはいわゆるOECD調和テンプレートに基づいてモデル化されています。OECD調和テンプレートはどんなタイプの化学品(たとえば、殺虫剤、殺生物剤、工業化学品)に関連するエンドポイント研究要約のための標準書式にもなります。 (参照D.4.7.1 What is an Endpoint study record?章)。
IUCLID does not prescribe how detailed the study summaries should be recorded. The fields provided should be considered as a maximum degree of detail. Older study reports or literature sources often do not provide the details for which many fields prompt for on a robust study summary level. On the other hand, more recently conducted studies and any new studies can be summarised in a very detailed manner. Refer to the relevant guidance for the respective chemical programme on how detailed studies need to be summarised. In the case of existing IUCLID 4 datasets prepared in the context of the OECD High Production Volume Chemicals Programme, EU Risk Assessment or for other purposes, which will be used for EU REACH, a pragmatic approach may have to be considered to avoid unnecessary additional work for adjusting these datasets to the new format in IUCLID 5.
IUCLIDには研究がどの程度に要約されて記載すべきか記載されていません。提供されているフィールドが最大限の詳細さであると考えるべきでしょう。古い情報源の研究レポートや文献では、フィールドの多くに要求される、ロバスト研究レベルの詳細さを提供していないことがしばしばあります。一方、極最近に実施された研究とこれから行われる研究ではどれも非常に詳細に要約されている場合があります。どの程度詳細に研究が要約される必要があるかは、それぞれの化学品プログラムに関する適切な手引きを参照してください。OECDの高生産量化学品プログラム、EUリスクアセスメント、その他の目的のために作成された既存のIUCLID4データセットにおいては、IUCLID5の新しいフォーマットに合わせるための不必要な追加的な仕事を避けるような実用的な手法が考えられるべきでしょう。
Note
Sections 11 Guidance on safe use, 12 Literature search and 13 Assessment Reports are not used for recording endpoint study summaries, but are also related to endpoint information.
セクション 11 Guidance on safe use11 安全な使用に関する手引き, 12 Literature search12 文献検索、13 Assessment Reports13 アセスメント報告書はエンドポイント研究要約のためには使用されないが、エンドポイントの情報に関連はしている。
Step-by-step guide
The following step-by-step guides are illustrated by screenshots based on fictitious sample data.
ステップ・バイ・ステップ手引き
次に記載するステップ・バイ・ステップの手引は架空のサンプルデータに基づいて、スクリーンショットを用いて説明しています。
Creating an Endpoint study record
エンドポイント研究レコードの作成
-
Open the Substance dataset as instructed in C.4.1 Entering/editing data in sections 1 to 3.
C.4.1 Entering/editing data in sections 1 to 3にしたがって表示されているSubstanceデータセットを開いてください。
-
Verify if the view mode "REACH Registration 1 - 10 tonnes, standard requirements" is selected (see chapter C.4.1 Entering/editing data in sections 1 to 3).
閲覧モードが"REACH Registration 1 - 10 tonnes, standard requirements"が選択されていることを確認してください(参照 C.4.1 Entering/editing data in sections 1 to 3章)。
-
Click the Plus symbol in front of section 4 Physical and chemical properties to display all subsumed subsections.
セクション4 Physical and chemical properties4. 物理的化学的性質の前にあるプラスシンボルをクリックして、要約されているすべてのセクションを表示してください。
-
Right-click section 4.2 Melting point/freezing point and from the menu displayed, click the New Endpoint study record command.
セクション4.2 Melting point/freezing point4.2 融点/凝固点を右クリックし、表示されるメニューから、New Endpoint study record(新エンドポイントレコードを作成)コマンドをクリックしてください。
-
A new record appears indicated by a green bullet
 . A default record name is generated and displayed both in the section tree pane and the record titlebar. This record name consists of the section title followed by a dot and a consecutive number, e.g. "Melting point/freezing point.001", as shown in the following screenshot.
. A default record name is generated and displayed both in the section tree pane and the record titlebar. This record name consists of the section title followed by a dot and a consecutive number, e.g. "Melting point/freezing point.001", as shown in the following screenshot.緑色の丸印
 で示された新しいレコードが現れます。デフォルトのレコード名が作成され、セクション・ツリー・ペインとレコードタイトル・バーの両方に表示されます。 このレコード名はセクションタイトルに続いてドットと連続番号で構成されています。たとえば、次のスクリーンショットで示されているように"Melting point/freezing point.001"などとなります。
で示された新しいレコードが現れます。デフォルトのレコード名が作成され、セクション・ツリー・ペインとレコードタイトル・バーの両方に表示されます。 このレコード名はセクションタイトルに続いてドットと連続番号で構成されています。たとえば、次のスクリーンショットで示されているように"Melting point/freezing point.001"などとなります。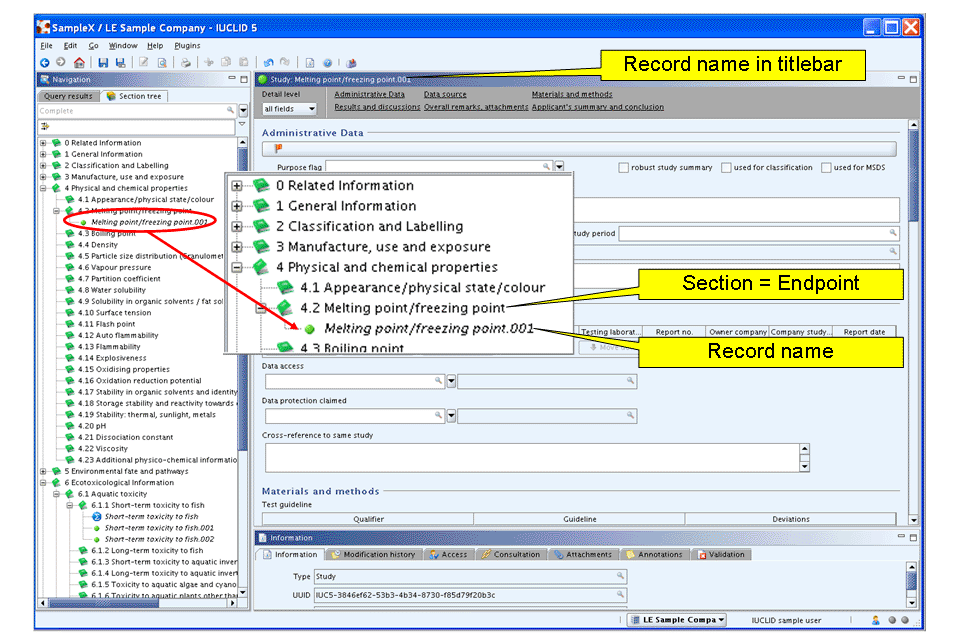
Renaming an Endpoint study record
エンドポイント研究レコードの名前の変更
-
Select the record in the section tree pane and either press the F2 key or right-click the record and from the menu displayed, click the Rename command.
セクション・ツリー・ペインのレコードを選択し、F2キーを押すか、レコードで右クリックして表示されるメニューからRenameコマンドを選択します。
-
Edit the record name as appropriate and then click OK.
適切にレコード名を編集し、OKをクリックします。入力補助: Hommel (1987)/key.001
Tip
It can be useful to add additional information or even replace the default record name by information that gives an overview of the value of that record on the fly. Example: "Hommel (1987)/key.001" (indicates the Author and Year and that the record contains a key study). For more information see chapter D.4.7.3 Renaming an Endpoint Study Record.
そのレコードの値の概要を手早く示す情報で、デフォルトのレコード名に追加的情報を加えるか、あるいは、レコード名を置き換えてしまうと役に立つでしょう。例:"Hommel (1987)/key.001" (著者と年と主要研究をレコードが含んでいることを示す) (詳細については、D.4.7.3 Renaming an Endpoint Study Record章に記載がある。)
Entering handbook data for section 4.2 Melting point/freezing point
セクション4.2 融点/凝固点のためのハンドブックデータの入力
This use case includes the entry of (limited) handbook data. It is assumed that the data are from a trusted source and can therefore be used as key study. (Note: Refer to the relevant guidance document for the regulatory programme as to whether handbook data are accepted to cover endpoints for physico-chemical properties.)
ここで使用する事例には(限定的な)ハンドブックデータの項目が含まれています。ここでは、そのデータは信頼されるデータであり、それゆえに主要研究として使用できることを仮定します。(注意: どのハンドブックデータを物理化学的性質に対するエンドポイントデータをカバーしていると受け入れられているかは適切な規制プログラムの手引きを参照してください。)
-
The newly created record in section 4.2 Melting point/freezing point should be open and displayed in the Data entry window. If not, double-click the record in the Section tree.
ここでセクション4.2 Melting point/freezing point4.2 融点/凝固点で新しく作成されたレコードが開いていてデータ入力ウィンドウが表示されているはずですが、もしそうでないなら、セクションツリー中の該当レコードをダブルクリックしてください。
Tip
Any newly created record will automatically be in the Edit mode. When you re-open a record, you need to click the Edit button
 on the toolbar.
on the toolbar.新しく作成されたレコードは自動的に編集モードになります。レコードを再度開いた時には、ツールバー上のEditボタン
 をクリックする必要があります。
をクリックする必要があります。 -
Part "Administrative Data": complete the appropriate fields as shown in the following screenshot:
"Administrative Data"(管理データ)パート: 次のスクリーンショットに示されている内容に従って、適切なフィールドを入力してください:
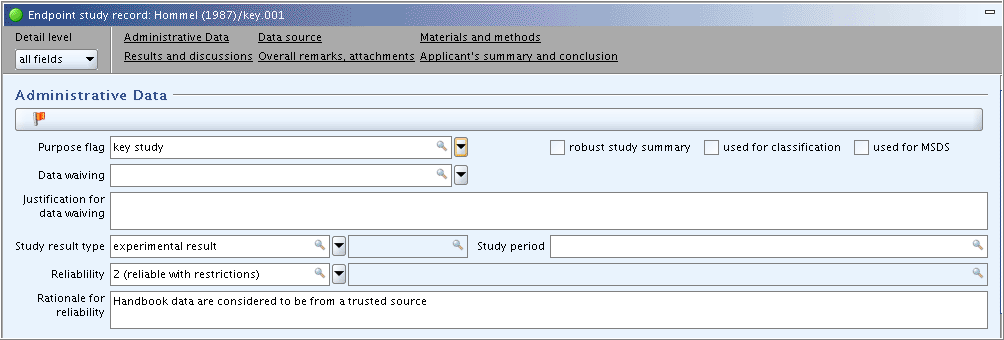
入力補助: Handbook data are considered to be from a trusted source
-
Part "Data Source": In field block
Reference, click the Add button and in the dialogue opened, select the Reference type and enter the bibliographic reference information as shown in the following screenshot. Other fields in this part are not applicable."Data Source"(データ出典)パート:
Reference参照ブロックで、 Addボタンをクリックして、開いたダイアログボックスで、Reference type(参照タイプ)を選択し、次のスクリーンショットに記載内容に従って、 参照情報の書誌情報を入力してください。このパートの他のフィールドは適用できない(not applicable)フィールドです。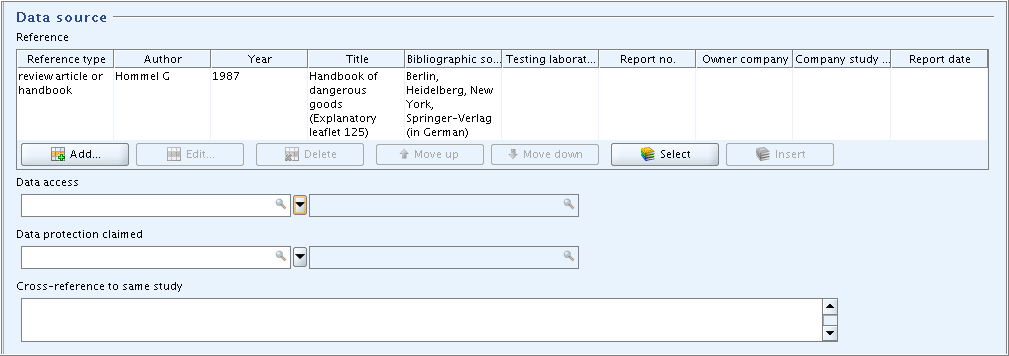
入力補助: review article or handbook
Hommel G
1987
Handbook of dangerous goods (Explanatory leaflet 125)
Berlin, Heidelberg, New York, Springer-Verlag (in German) -
Part "Materials and methods": The only field that can be completed in this example is the field
GLP compliance."Materials and methods"(材料と方法)パート: この事例で入力できるフィールドは
GLP complianceGLP準拠フィールドだけです。 -
Part "Results and discussions": In field block
Melting / freezing point, click the Add button and in the dialogue opened, enter the freezing point in degree Centigrade. If required, repeat this procedure and enter the corresponding value in kelvin."Results and discussions"(結果と考察)パート:
Melting / freezing point融点/凝固点フィールドブロックで, Add(追加)ボタンをクリックして開くダイアログボックスで融点を摂氏で入力してください。もし、必要があれば、この手順を繰返しケルビンで対応する値を入力してください。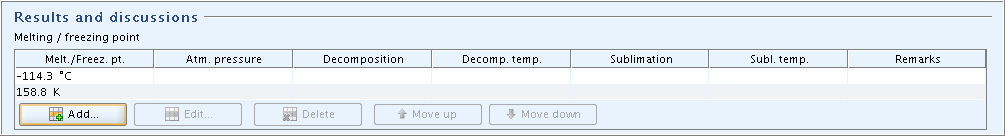
入力補助: 度記号(°)の入力
文字コード表を使用する: Windowsのスタートボタンから[すべてのプログラム]-[アクセサリ]-[システムツール]-[文字コード表]を選択すると文字コード表が開きます:
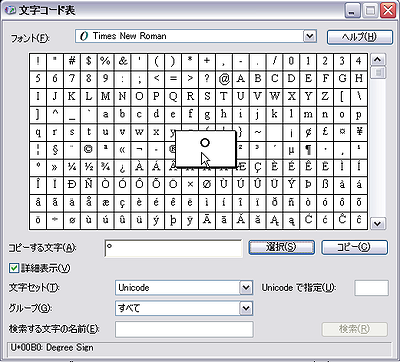
-
If you continue creating another Endpoint study record, a dialogue will ask you to save the modified data. Confirm by clicking the Save button.
もう一つ続けてエンドポイント研究レコードを作成しようとすると、ダイアログボックスがその修正データを保存するか尋ねてきます。 Save(保存)ボタンをクリックして確認をしてください。
Important
重要
If you discontinue working with IUCLID for a longer time (i.e. more than two hours), it is recommended to click the Save
 button on the toolbar to make sure that the data entered are saved. Otherwise a session timeout might occur causing IUCLID to stall. The data could then not be saved anymore.
button on the toolbar to make sure that the data entered are saved. Otherwise a session timeout might occur causing IUCLID to stall. The data could then not be saved anymore.IUCLIDを継続して、長時間(すなわち2時間以上)使わない場合は、ツールバー上のSave
 (保存)ボタンをクリックして確実に入力データを保存するようにしてください。そうしないとセッション・タイムアウトが起こって、そのためにIUCLIDを失速するかもしれません。
(保存)ボタンをクリックして確実に入力データを保存するようにしてください。そうしないとセッション・タイムアウトが起こって、そのためにIUCLIDを失速するかもしれません。
Entering the basic data of a study in section 6.1.1 Short-term toxicity to fish
セクション6.1.1 短期魚毒性 研究の基礎的データの入力
This use case includes the entry of the basic data of a study in an Endpoint study record. It is assumed that only limited information is available from a publication and and executive summary of a study report. But the study report itself is not available yet. This use case is intended to demonstrate the Detail level switch, how to use basic fields only, launching the online help, handle a comprehensive drop-down list, use a Freetext template and the Undo function.
この事例では、エンドポイント研究レコードにある研究の基礎的データを入力することが含まれています。ここではある出版物からの限られた情報が入手可能で、研究レポートの要旨(executive summary)は得られているが、研究レポートそのものはまだ入手されていないもの仮定しています。この事例では、詳細レベル(Detail level)の切替、基礎的フィールドのみの使用方法、オンラインヘルプの起動の仕方、選択肢を包括的に含むドロップダウンリストの取扱い、フリーテキストテンプレートの使用、アンドゥ(Undo やり直し)機能について実地に説明することを目的としています。
-
Create a new Endpoint study record in section 6.1.1 Short-term toxicity to fish.
6.1.1 Short-term toxicity to fish6.1.1 短期魚毒性セクション内での新しいエンドポイント研究レコードの作成
-
Rename the record to "Dorgerloh (1992)"
レコードの名前を"Dorgerloh (1992)"に変更してください。
-
Click the Detail level button below the record title bar and from the menu displayed, select "basic fields".
レコード・タイトル・バーの下のDetail level(詳細レベル)ボタンをクリックして、現れるメニューから、"basic fields"(基礎的フィールド)を選択してください。
Note
As described in chapter D.4.7.1 What is an Endpoint study record?, IUCLID allows displaying either the basic fields only or all fields, i.e. including additional fields, which are normally only relevant for robust study summaries. The field labels of any additional fields are set in blue colour, while the label of all basic fields is black.
D.4.7.1 What is an Endpoint study record?に記載されているように、 IUCLIDではbasic fields(基礎的フィールド)のみか、すべてのフィールド(基礎的フィールド+追加フィールド)のいずれかを表示させるようになっていて、追加フィールドは通常はロバスト研究要約にのみ関連しており、そのフィールド・ラベルはいずれも青色に設定されてます。それに対して、基礎的データのフィールドラベルはすべて黒色です。
-
Part "Administrative Data": In field
Study result type, select "experimental study". In fieldStudy period, enter "1991" as assumingly indicated in the publication. Other fields are left empty for the time being."Administrative Data"(管理データ)パート:
Study result type研究結果タイプフィールドで、"experimental study"(実験研究)を選択してください。Study period研究時期フィールドに、"1991"を出版が行われたと思われる年として入力してください。そのほかのフィールドはさしあたりは空にしておきます。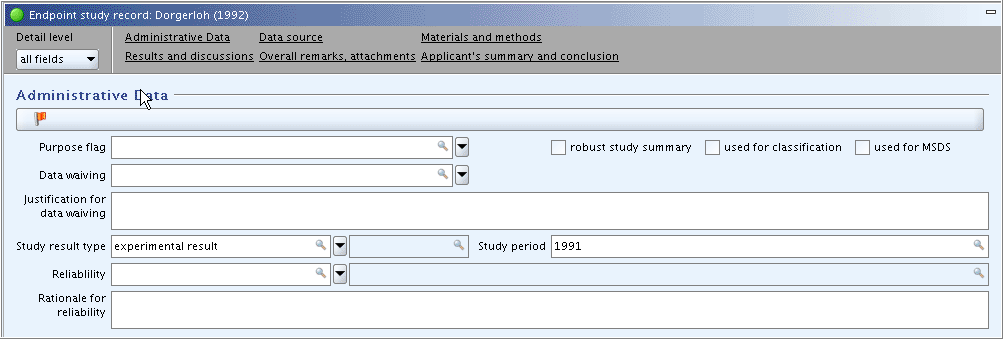
-
Part "Data Source":
"Data Source"(データ出典)パート:
-
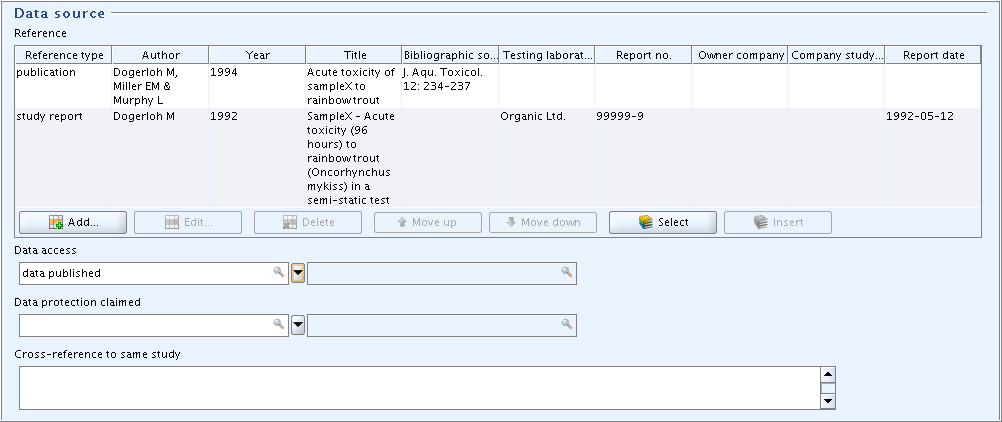
In field block
Reference, enter the two references shown in the screenshot:Reference参照フィールドブロックで、スクリーンショットに示されている2つの参照(文献情報)を入力してください:-
Launch the context-sensitive online help from within any field via the F1 key or by clicking the Help button
 on the toolbar.
on the toolbar.いずれかフィールドからオンラインのコンテキスト・ヘルプを起動してください。そうするにはF1キーを押すか、ツールバー上のHelpボタン
 を押します。
を押します。 -
Customise the size of the Help window as appropriate (If you need to look up online help for fields frequently, it can be useful to position both the Help window and the IUCLID screen in such a way that both windows are visible without having to switch back and forth. However, the context-sensitive help for each field has to be explicitly evoked by pressing the F1 key or clicking the Help button
 .)
.)ヘルプ・ウィンドウのサイズを適切にカスタマイズしてください(もしフィールドについてのオンラインヘルプをしばしば見る必要があるのであれば、ヘルプウィンドとIUCLID画面の両者を切り替えて行ったり来たりしなくても見えるように位置を調整するとよいかもしれない。しかしながら、各フィールドに対するコンテキスト・ヘルプはF1キーを押すか、Help ボタン
 を押すかして明示的に呼び出さなければならない。)
を押すかして明示的に呼び出さなければならない。) -
Enter the bibliographic data as appropriate.
適切に書誌事項データを入力してください。
-
-
In field
Data access, select the item "data published".フィールド
Data accessデータ出典で、"data published"(公表データ)を選択してください。
入力補助:
publication; Dogerloh M, Miller EM & Murphy L; 1994; Acute toxicity of sampleX to rainbowtrout; J. Aqu. Toxicol. 12:234-237
study report; Dogerloh M; 1992; SampleX - Acute toxicity (96 hours) to rainbowtrout (Oncorhynchus mykiss) in a semi-static test; ; Organic Ltd.; 99999-9; 1992-05-12
-
-
Part "Materials and methods":
"Materials and methods"(材料と方法)パート:
-
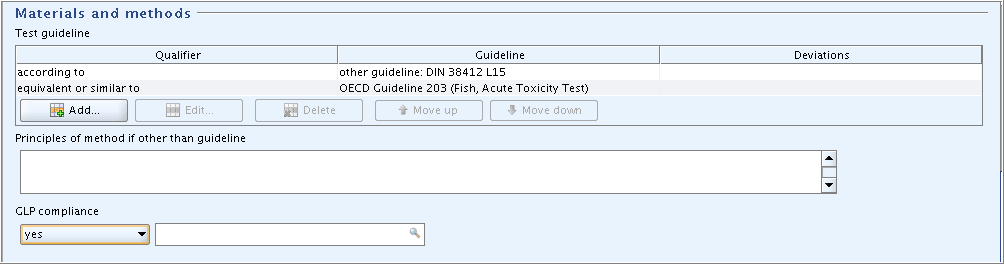
Enter the guideline given in the data source: Select "according to" in the field
Qualifier. Select "other guideline" in the fieldGuideline, because the guideline used is not listed in the picklist, and enter "DIN 38412 L15" in the associated text field.データ出展に記載されているガイドラインを入力してください:
Qualifier限定詞フィールドで"acoording to"(に準拠)を選択してください。 使用したガイドラインはピックリストにリストアップされていないので、Guidelineガイドラインフィールドで"other guideline"(その他のガイドライン)を選択し、関連テキストフィールド(associated text field)で"DIN 38412 L15"と入力してください。 -
Indicate that this guideline is equivalent to OECD Guideline 203: Repeat this procedure, but select the appropriate items from the picklists as shown in the screenshot below.
このガイドラインがOECDガイドライン203と同等であることを記載してください: この手順を繰返し、下のスクリーンショットの記載に従って、適切な項目をピックリストから選択してください。
-
Select "yes" in the field
GLP compliance.GLP complianceGLP 準拠フィールドで"yes"を選択してください。
入力補助:
according to; other guideline: DIN 38412 L15
equivalent or similar to; OECD Guideline 203 (Fish, Acute Toxicity Test)
-
-
Part "Test materials":
"Test materials"(試験材料)パート:
-
Fields related to the identity of the test material are filled automatically based on the Reference substance assigned to the Substance dataset (see chapter C.3 Creating a dataset for a Substance and assigning a Reference substance). You can add any additional identifiers.
試験材料の特定に関連しているフィールドはSubstanceデータセットを割り当させた参照物質に基づいて自動的に埋められます。 (参照C.3 Creating a dataset for a Substance and assigning a Reference substance章). どんな識別子でも入力できます。
Note
If the study was conducted with another than the submission substance (i.e. as identified by the Reference substance) and used as read-across, you would have to update these fields accordingly.
もしその研究が申請物質(すなわち参照物質によって特定されている物質)とは別の物質で実施されている場合や読込(read-across)として使用されている場合は、これらのフィールドはそれに応じて更新されなければならないでしょう。
-
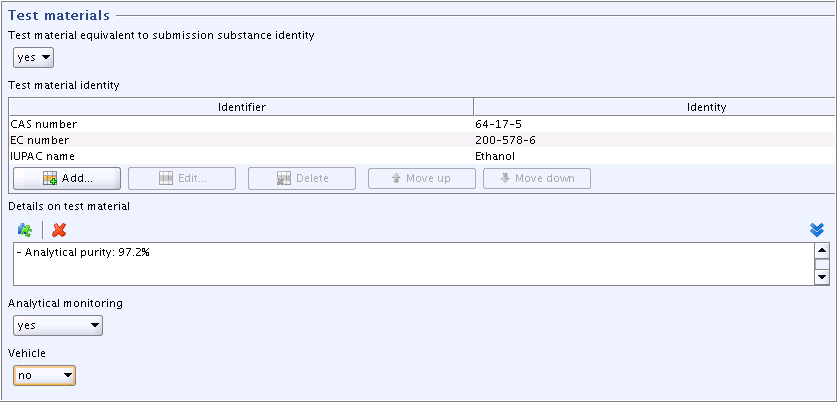
Field
Details on test material: Click the puzzle-like icon below the field label. In the Freetext templates dialogue box that opens, edit the Freetext template provided in such a way that only the item "- Analytical purity:" is kept, while all other items are deleted. Specify as shown in the screenshot below.
below the field label. In the Freetext templates dialogue box that opens, edit the Freetext template provided in such a way that only the item "- Analytical purity:" is kept, while all other items are deleted. Specify as shown in the screenshot below.Details on test material試験材料の詳細フィールド:フィールドラベルの下のパズルのようなアイコン をクリックしてください。開いたフリーテキスト・テンプレート・ダイアログボックスで、項目" - Analytical purity:"のみを残し、その他の項目は削除するようにして、フリーテキスト・テンプレートを編集してください。下のスクリーンショットに示すように記載してください。
をクリックしてください。開いたフリーテキスト・テンプレート・ダイアログボックスで、項目" - Analytical purity:"のみを残し、その他の項目は削除するようにして、フリーテキスト・テンプレートを編集してください。下のスクリーンショットに示すように記載してください。 -
Complete the fields
Analytical monitoring("yes") andVehicle("no").Analytical monitoring分析のモニタリングフィールドに"yes"と、Vehicleビヒクルフィールドに "no"と入力してください。
-
-
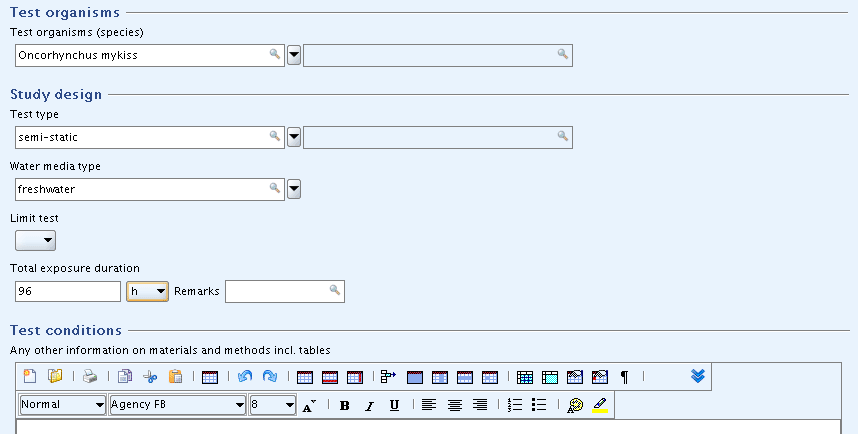
Parts "Test organisms", "Study design" and "Test conditions": Enter the basic data as shown in the screenshot below.
"Test organisms"(試験生物)パート、 "Study design"(研究デザイン)パート、 "Test conditions"(試験条件)パート:下のスクリーンショットに示されているように基礎的データを入力してください。
Tip
In case of very comprehensive picklists provided in a drop-down combo box, you can find the desired item quickly by using either of the following methods:
ドロップダウン・コンボ・ボックスで提供されている包括的ピックリストの場合、次に記載の方法のいずれかを使用して望む項目を見つけ出すことができる:
-
Click the drop-down arrow and in the picklist that opens, click into the Find pane
 and enter an adequate part of the item. For example, "my" will immediately find any item that contains this string, e.g. "Oncorhynchus mykiss". You need not use wildcards (*) and such on the-fly queries are not case-sensitive.
and enter an adequate part of the item. For example, "my" will immediately find any item that contains this string, e.g. "Oncorhynchus mykiss". You need not use wildcards (*) and such on the-fly queries are not case-sensitive.ドロップダウンの矢印をクリックして開くピックリストから、クリックしてFindペイン
 に入り、項目の必要十分な部分を入力してください。たとえば、"my"と入力すると直ちにこの文字列を含むすべての項目、たとえば、"Oncorhynchus mykiss"が見つかります。 必ずしもワイルドカード(*)を使用する必要もありません。この迅速な検索(query)はケース・センシティブではありません。
に入り、項目の必要十分な部分を入力してください。たとえば、"my"と入力すると直ちにこの文字列を含むすべての項目、たとえば、"Oncorhynchus mykiss"が見つかります。 必ずしもワイルドカード(*)を使用する必要もありません。この迅速な検索(query)はケース・センシティブではありません。 -
Just start typing the item of your choice in the list field. The autofill function of IUCLID will display the first entry in the list starting with the letter(s) you enter. For example, typing "O" or "o" will extend to "Oncorhynchus gorbuscha". When you then click the drop-down arrow, the first entry in the list starting with that/these letter(s) will be displayed directly and you can find the desired item (e.g. "Oncorhynchus mykiss") right away.
そのリストのフィールドに、あなたの選択項目を直接入力し始めてください。IUCLIDの自動入力機能(autofill function)によって、あなたが入力した文字で始まる、リスト中の最初の項目が表示されます。たとえば、"O"または"o"と入力すると、"Onchorhynchus gorbuscha"が得られるでしょう。そのあとドロップダウンの矢印をクリックすると、その文字(列)で始まるリストの最初の項目が直接表示され、あなたが欲しい項目(例: "Onchorhyncus mykiss")をすばやく得ることができます。
-
-
Part "Results and discussions": In the field block
Effect concentrations, click the Add button and in the dialogue opened, enter the LC50 value and the parameters shown in the following screenshot:"Results and discussions"(結果と考察)パート:
Effect concentrations影響濃度フィールド・ブロックで、Addボタンをクリックして開くダイアログで、次のスクリーンショットに示されているLD50値とパラメータを入力してください: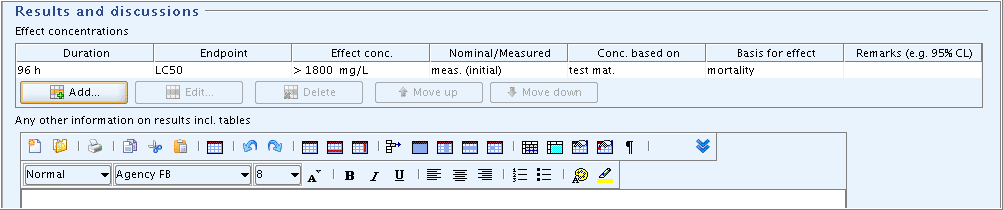
-
Part "Overall remarks, attachments": Nothing to add for this sample study.
"Overall remarks, attachments"(総括的要約、添付)パート: この事例の研究では追加するものはありません。
-
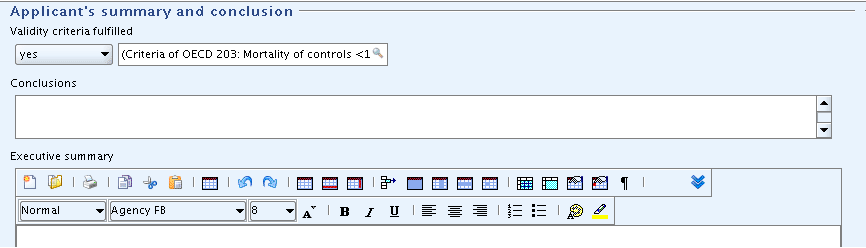
Part "Applicant's summary and conclusion": In field
Validity criteria fulfilled, select "yes" and add a brief explanation in the related text field."Applicant's summary and conclusion"(申請者による要約と結論):
Validity criteria fulfilled妥当性の基準が満たされているか、"yes"を選択し関連するテキスト・フィールドに簡単な説明を追加してください。Tip
In print-outs, the supplementary text field related to the list field is not separated by any delimiter. This might cause confusing text combinations. It is therefore recommended to include any supplementary text in parentheses to get it set aside from the list item. This is not required if the picklist item end with a colon as for "other:".
印刷出力では、リストフィールドに関連する補足的テキストフィールドは区切り文字(デリミタ)で分けられていません。これはテキストの組み合わせで混乱を起こすかもしれません。そのため補足的テキストは括弧で括ってリスト項目とそれを分けておくことを推奨します。もしピックリストの項目が"other:"のような形でコロンで終わっている場合には必要ありません。
入力補助:
(Criteria of OECD 203: Mortality of controls <1)
-
Test the Undo function: Delete the entry in field
Validity criteria fulfilledby selecting the blank item. Then click the Undo button on the toolbar. The previous picklist item will be re-entered, but not the related text field.
on the toolbar. The previous picklist item will be re-entered, but not the related text field.Undo(アンドゥ、やり直し)機能:
Validity criteria fulfilled妥当性の基準が満たされているかのフィールドの項目を、空白の項目を選択することによって、削除してください。ツールバー上のUndoボタン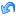 をクリックしてください。前に選択したピックリスト項目が再表示されますが、関連テキストフィールドは再表示されません。
をクリックしてください。前に選択したピックリスト項目が再表示されますが、関連テキストフィールドは再表示されません。Note
Using the Undo command, the most recent edit operations can be undone in most cases. There are a few exceptions to this rule as demonstrated with the example above.
Undoコマンドを使えば、直近の編集操作をやり直す(Undo)することができますが、上の例で示されたように、これには2,3の例外があります。
Copying an Endpoint study record
エンドポイント研究レコード
Use case: To demonstrate the Copy function it is assumed that the Endpoint study record prepared in the sample above shall be expanded to a robust study summary, while the first draft record shall be stored. Proceed as follows:
使用する事例:Copy(コピー)機能を実習するために上で使用した事例で作成したエンドポイント研究レコードを拡張してロバスト研究要約を作成するケースを想定します。ただし、最初のドラフトのレコードは保存されているものとします。次の手順にしたがって作業を実施してください:
-
Right-click the record "Dorgerloh (1992)" in the section tree pane and from the menu displayed, click the Copy command.
セクション・ツリー・ペイン中のレコード"Dorgerloh (1992)"を右クリックして開くメニューからCopyコマンドをクリックしてください。
-
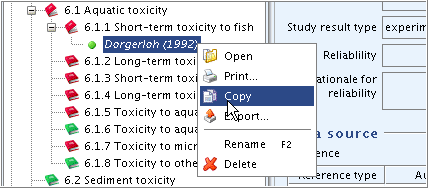
The clipboard manager is opened and the copied record is displayed.
クリップボード・マネージャーが開き、コピーしたレコードが表示されます。
-
Select and highlight the copied record in the clipboard and click the Paste selected items
 button. The record will then appear in the section tree under the same name as the orginal one.
button. The record will then appear in the section tree under the same name as the orginal one.クリップボード中のコピーされたレコードを選択し、反転させて、Paste selected items
 (選択項目をペーストする)ボタンをクリックしてください。 そうするとレコードはオリジナルと同じ名前でセクション・ツリーに現れます。
(選択項目をペーストする)ボタンをクリックしてください。 そうするとレコードはオリジナルと同じ名前でセクション・ツリーに現れます。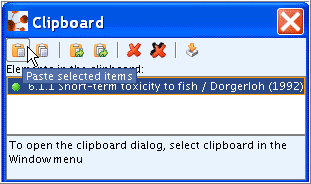
-
Rename one record to "Dorgerloh (1992)/draft (basic data)" and the other one to "Dorgerloh (1992)/key".
一つのレコードの名前を"Dorgerloh (1992)/draft (basic data)"に変更し、いまひとつを"Dorgerloh (1992)/key"に変更してください。

Ordering Endpoint study records
エンドポイント研究レコードを順に並べる方法
Use case: Reorder records in the section tree to position the record designated as "key study" first (useful in case of many records per Endpoint section). Proceed as follows:
使用する事例: セクション・ツリー中のレコードを並び替えて"key study"(主要研究)が最初に来るようにレコードの位置を変えてください。(エンドポイント・セクションあたりにレコードの数が多いケースで役に立つでしょう)。次の手順に従って作業を実施してください:
-
Right-click the section title 6.1.1 Short-term toxicity to fish and from the menu displayed, click the Order records command.
セクション・タイトル6.1.1 Short-term toxicity to fish6.1.1 魚短期毒性をクリックして開くメニューからOrder recordsコマンドをクリックしてください。
-
In the dialogue box, highlight the record designated as "key study", click the Move up arrowto position it first and then click OK.
ダイアログボックス内で"key study"(主要研究)に指定したレコードを反転させてください。続いてMove up arrow(上矢印) をクリックしてそのレコードを先頭に移し、それからOKボタンを押してください。
-
The key study then appears as first record.
これで主要研究が最初のレコードとなりました。
Quickly finding specific Endpoint study records in the section tree
セクション・ツリー中の特定のエンドポイント研究レコードをすばやく見つける方法
Use case: Especially if a section contains a large number of Endpoint study records, the query / filter method should be used to quickly filter for specific records.
使用事例:もしエンドポイント研究レコードが多数含まれているセクションの場合、そのquery/filter method (検索/篩い分け手法)が特定のレコードをすばやく篩い分けるのに用いられるだろう。
To query and find a record
レコードを検索し見つけるために
-
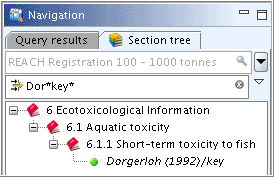
Click into the Find or Filter pane
 below the title bar of the section tree pane.
below the title bar of the section tree pane.セクション・ツリー・ペインのタイトルバーの下にあるFind or Filter pane
 (検索あるいは篩い分けのペイン)にクリックして入る。
(検索あるいは篩い分けのペイン)にクリックして入る。 -
Enter an adequate part of the record name and all records containing this search string in their names will be filtered out and displayed immediately. For example, "Dor" (without quotation marks) will select records starting with this string. "Dor*key" will find the record "Dorgerloh (1992)/key".
見つけたいレコード名の必要十分な部分を入力してください。すると、その名前の検索語を含むすべてのレコードが篩わけられ直ちに表示されます。たとえば、"Dor"(引用符は不要)はこの文字列で始まるすべてのレコードが選択されます。【訳注: 実際には「始まる」ではなく「を含む」である】 "Dor*key"と入力すれば"Dorgerloh (1992)/key"のレコードが見つかります。
Tip
Use wildcards (*) for any characters preceding or following a search string.
ワイルドカード(*)を探したい文字の前後の任意の複数文字として使用してください。
Entering additional data for a robust study summary in section 6.1.1 Short-term toxicity to fish
セクション6.1.1の短期魚毒性 ロバスト研究要約のための追加的なデータの入力方法
Use case: It is assumed that the full study report is now available and can be used to prepare a robust study summary. This use case is intended to demonstrate the Detail level "all fields", the Navigation links to the main parts of an Endpoint study record, the use of comprehensive Freetext templates, sorting of items in repeatable blocks of fields, using a rich text field and uploading a predefined table, and other edit functions.
使用する事例:完全研究報告が今入手可能であり、ロバスト研究要約を作成するために使用できるとします。この実習で使用する事例では、Detail Level(詳細レベル)"all fields"(全フィールド)について実習し、エンドポイント研究要約の主要部分へのナビケータ(案内役)リンク、包括的なFreetextテンプレートの使用、フィールドの反復ブロックでの項目の並び替え、リッチテキストフィールドの使用と事前に定義された表のアップロード、そして、その他の編集機能について実習することを狙いとしています。
-
Find the record "Dorgerloh (1992)/key" in the section tree and double-click it to open it.
セクションツリー中のレコード"Dorgerloh (1992)/key"を見つけそれをダブルクリックして開いてください。
-
Click the Edit button
 on the toolbar to allow editing of the record.
on the toolbar to allow editing of the record.ツールバー上のEditボタン
 をクリックして、そのレコードを編集可能にしてください。
をクリックして、そのレコードを編集可能にしてください。 -
Click the Detail level button below the record title bar and from the menu displayed, select "all fields".
レコード・タイトル・バーの下にあるDetail level(詳細レベル)ボタンをクリックして表示されるメニューから、"all fields"(フィールド全部)を選択してください。
-
Part "Administrative Data": Complete the field
Purpose flag, select the checkbox for "robust study summary" and specify the study period in the corresponding field as shown in the following screenshot. (Note: FieldsReliabilityandRationale for reliabilitywill be completed later, when the study has been evaluated and the robust study summary is completed.)"Administrative Data"(管理データ)パート: 下のスクリーンショットの内容に従って
Purpose flag(目的フラッグ)フィールドを埋めてください、続いて、"robust study summary"(ロバスト研究要約)チェックボックスを選択し、対応するフィールドの研究時期を入力してください。(注意:Reliability信頼性フィールドとRationale for reliability信頼性の理由は後で、その研究を評価しロバスト研究要約の入力を終えてから、入力することになります。)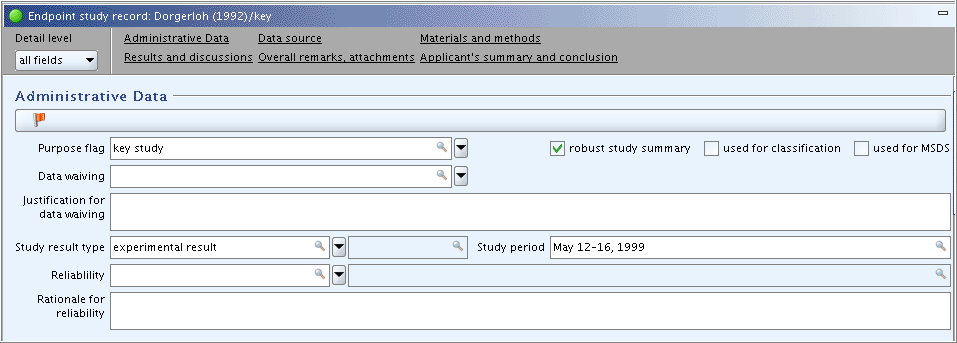
入力補助:
study period: May 12-16, 1999 -
Part "Test materials":
"Test materials"(試験材料)パート:
-
Add additional information in field
Details on test material. Click the Freetext template icon below the field label. In the Freetext templates dialogue box that opens, edit the Freetext template provided in such a way that only the needed items are kept, while all other items are deleted. Specify as shown in the screenshot below.
below the field label. In the Freetext templates dialogue box that opens, edit the Freetext template provided in such a way that only the needed items are kept, while all other items are deleted. Specify as shown in the screenshot below.Details on test material試験材料の詳細フィールドに追加情報を入力してください。そのフィールドラベルの下のフリーテキスト・テンプレート・アイコン をクリックしてください。開いたフリーテキスト・テンプレート・ダイアログ・ボックスで、必要な項目を残したまま、その他の項目をすべて削除して、そのフリーテキストテンプレートを編集してください。下のスクリーンショットに示されるように記載してください。
をクリックしてください。開いたフリーテキスト・テンプレート・ダイアログ・ボックスで、必要な項目を残したまま、その他の項目をすべて削除して、そのフリーテキストテンプレートを編集してください。下のスクリーンショットに示されるように記載してください。 -
Field
Confidential details on test material: Select the item "- Lot/batch No.:" from the Freetext template and add data as shown in the screenshot below. (Note: Any information that can be claimed confidential (e.g. composition, impurities, lot/batch no.) should be included in this field, because this will allow to filter out such data from any print-out or export file.)Confidential details on test material試験材料の詳細(機密情報): フリーテキスト・テンプレートから"- Lot/batch No.:"の項目を選択し、下のスクリーンショットに示されているようにデータを入力してください。 (注意: このフィールドには機密を主張できるような情報(例: 組成、不純物、ロット/バッチ番号)を含めるべきである。なぜなら、これにより任意の印刷出力とエクスポートファイルからそのようなデータを篩い分けることができるからである)。 -
Field
Details on properties of test surrogate or analogue material: Leave this field empty, because it is only relevant in case of read-across from another substance, e.g. an analogue or surrogate.Details on properties of test surrogate or analogue material代わりのあるいは類似の試験材料の性質に関する詳細:このフィールドは空のままにして置いてください、というのは、このフィールドは、他の一つの物質、たとえば、類似物質や代理物質から読み込み法(read-across)の場合にのみ使用するのが適切であるからです。
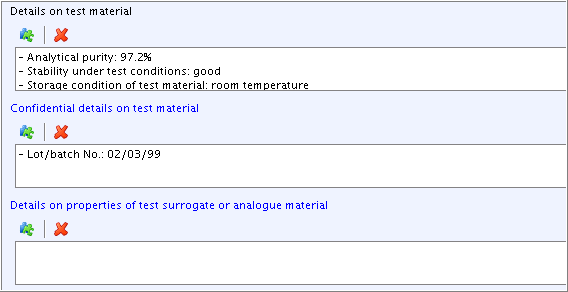
入力補助:
- Analytical purity: 97.2%
- Stability under test conditions: good
- Storage condition of test material: room temperature
- Lot/batch No.: 02/03/99
-
-
Part "Test organisms", field
Details on test organisms: Select and edit the Freetext template as shown in the following screenshot."Test organisms"(試験生物)パート、
Details on test organisms試験生物の詳細:フリーテキスト・テンプレートを選択肢、次のスクリーンショットに示すように入力してください。Tip
Click the Unfold button
 on the upper right of the field to expand the field or the Fold button
on the upper right of the field to expand the field or the Fold button  to minimise the display area.
to minimise the display area.フィールドの右上にあるUnfold button(展開ボタン)
 をクリックして、フィールドを展開してください。 Fold button(折畳ボタン)
をクリックして、フィールドを展開してください。 Fold button(折畳ボタン)  をクリックして、表示領域を最小化してください。
をクリックして、表示領域を最小化してください。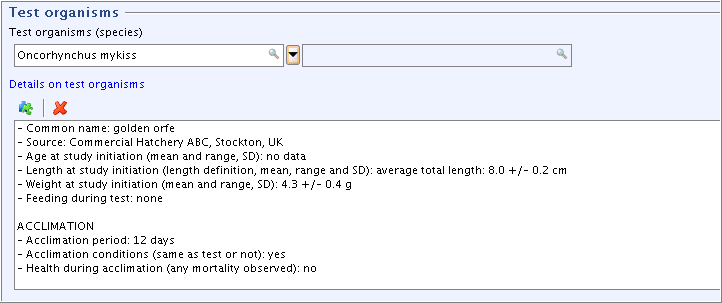
入力補助:
Oncohynchus mykiss
- Common name: golden orfe
- Source: Commercial Hatchery ABC, Stockton, UK
- Age at study initiation (mean and range, SD): no data
- Length at study initiation (length definition, mean, range and SD): average total length: 8.0 +/- 0.2 cm
- Weight at study initiation (mean and range, SD): 4.3 +/- 0.4 g
- Feeding during test: none
ACCLIMATION - Acclimation period: 12 days
- Acclimation conditions (same as test or not): yes
- Health during acclimation (any mortality observed): no
-
Part "Test conditions": Complete the fields
Hardness,Test temperature,pH,Dissolved oxygen, andNominal and measured concentrationsas shown in the following screenshot."Test conditions"(試験条件)パート: 次のスクリーンショットに示されているように、
Hardness硬度、Test temperature試験温度、pHpH,Dissolved oxygen溶存酸素、Nominal and measured concentrations設定濃度と測定濃度を入力してください。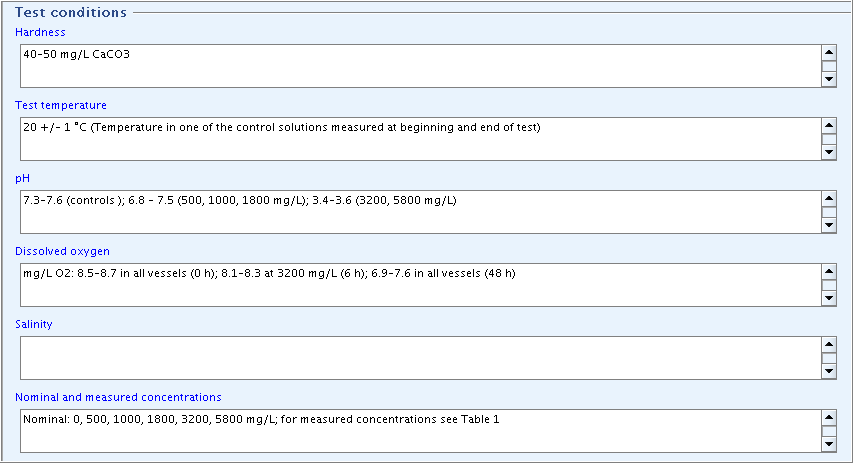
入力補助:
Hardness: 40-50 mg/L CaCO3
Test temperature: 20 +/- 1°C(Temperature in one of the control solutions measured at beginning and end of test)
pH: 7.3-7.6 (controls); 6.8-7.5 (500, 1000, 1800 mg/L); 3.4-3.6 (3200, 5800 mg/L)
Dissolved oxygen: mg/L O2: 8.5-8.7 in all vessels (0 h); 8.1-8.3 at 3200 mg/L (6 h); 6.9-7.6 in all vessels (48 h)
Salinity:
Nominal and measured concentrations: Nominal: 0, 500, 1000, 1800, 3200, 5800 mg/L; measured concentrations see Table 1
-
Part "Test conditions" (cont'd), field
Details on test conditions: Select and edit the Freetext template as shown in the following screenshot."Test conditions"(試験条件)(続き)、
Details on test conditions試験条件の詳細:次のスクリーンショットの示されるようにフリーテキストを選択して入力して下さい。
-
Field
Any other information on materials and methods incl. tables: Upload a predefined or other available table into this rich text field as follows:Any other information on materials and methods incl. tables表を含む材料と方法に関する任意のその他の情報: 前もって定義しておいた表あるいはその他の利用可能な表をアップロードして次のようにリッチテキストフィールドに入力してください:-
Click the Open file button
 on the toolbar of the rich text editor.
on the toolbar of the rich text editor.リッチテキストエディタのツールバー上のOpen file(ファイルを開く)ボタン
 をクリックしてください。
をクリックしてください。 -
From the Open dialogue box displayed, select the file you wish to upload into the field, and then click the Open button.
表示されるOpenダイアログボックスから、あなたがそのフィールドにアップロードしたいファイルを選択して、Openボタンをクリックして下さい。
-
Edit the table as appropriate.
適切に表を編集してください。
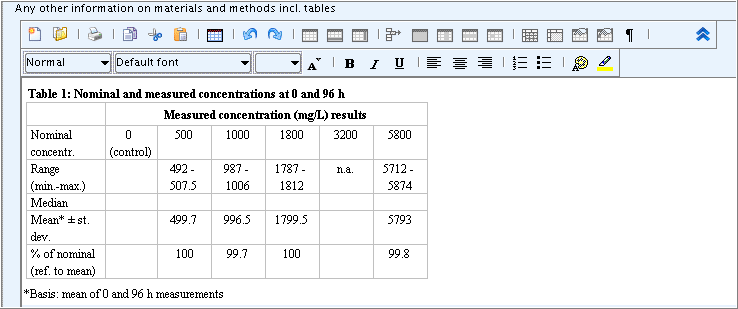
-
-
Part "Results and discussions": Add additional effect concentration data in the field block
Effect concentrationsand details in the fieldDetails on resultsas shown in the following screenshot:"Results and discussions"(結果と考察)パート: 次の示すスクリーンショットに示されているように
Effect concentrations影響濃度フィールドブロックに追加的な影響濃度データ、Details on results結果の詳細フィールドに詳細を入力してください: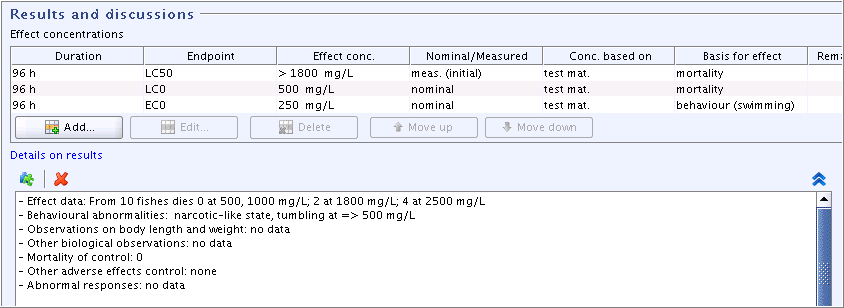
-
Part "Administrative Data": The fields
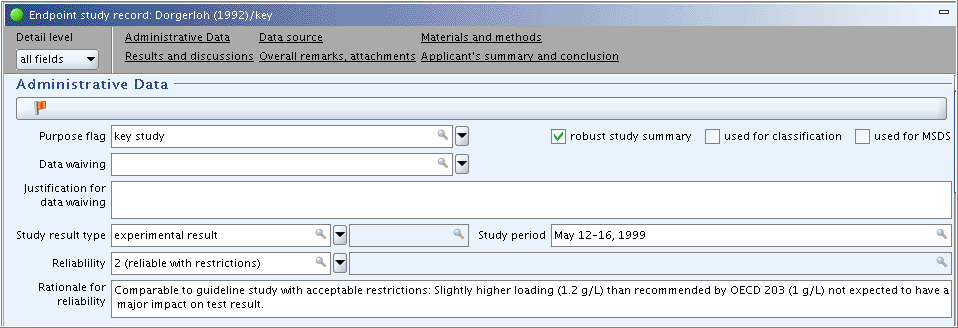
ReliabilityandRationale for reliabilitystill need to be completed based on the inherent quality of the test report or publication and hence, the adequacy of data. Proceed as follows:"Administrative Data"(管理データ)パート:
Reliability信頼性とRationale for reliability信頼性に対する理由が試験報告書あるいは出版物の本質的な品質に基づいて入力が必要であり、それゆえデータの十分さ(adequacy)に基づいて入力する必要があります。 次のように処理してください:-
Click the link "Administrative data" in the navigation bar just below the title bar to jump directly to that part.
タイトルバーの真下のナビゲーションバーにある"Administrative data"(管理データ)リンクをクリックし、直接そのパートにジャンプしてください。
Tip
Using the links on the navigation bar is particularly helpful in case of very comprehensive Endpoint study records or if you prefer to start editing or viewing with a particular part, e.g. "Results and discussion".
そのナビゲーションバーの上のリンクは、特に、非常に広範なエンドポイント研究レコードの場合に使用すれば役に立ちます。あるいは、もし特定の部分、たとえば、"Results and discussion"(結果と考察)の特定の部分の編集、あるいは、閲覧を始めたい場合にも役に立ちます。
-
Complete the fields
ReliabilityandRationale for reliabilityas shown in the following screenshot.Reliability信頼性フィールドとRationale for reliability信頼性に対する理由フィールドを、次のスクリーンショットに示されているように入力してください。 -
Click the link "Applicant's summary and conclusions" to jump to that part and proceed.
"Applicant's summary and conclusions"(申請者の要約と結論)のリンクをクリックして、そのパーツにジャンプし、処理してください。
-
-
Part "Applicant's summary and conclusion":
"Applicant's summary and conclusion"(申請者の要約と結論)パート:
入力補助:
excel表